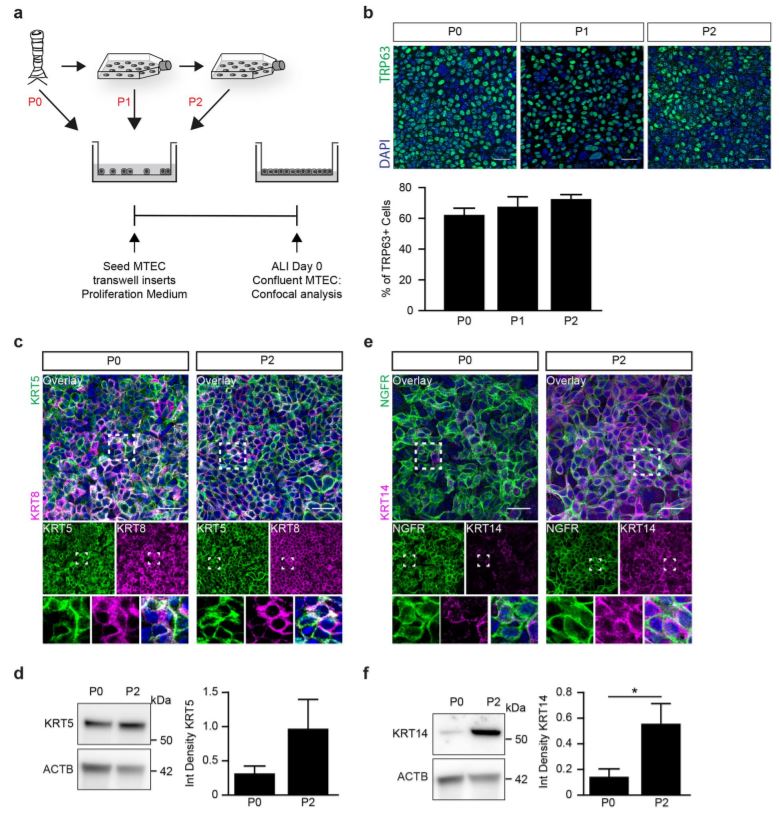
Results
Serum free medium and the inhibition of Notch signaling enables basal cell expansion. Although the current methods of ALI culture represent the pseudostratifed airway epithelium in vitro, a limitation of this technique is the relatively low number of cells obtained from a trachea. We frst validated the existing culturing method of MTEC whereby isolated MTEC are cultured directly onto transwell inserts (Fig. S1). Tis culture method allowed us to plate approximately 4 to 5 transwell inserts (50,000 cells per insert) using two mice (±100,000 cells per trachea). Improving the expansion of MTEC will allow for multiple experiments to be performed with fewer mice. Ideally, following isolation from the trachea, cells can be expanded in culture for at least two passages to generate sufcient cells for multiple experiments (Fig. 1a). In previous studies, MTEC are isolated and plated on inserts in proliferation medium and upon reaching confuency, cultured at ALI in diferentiation medium (Table S1)13,14. Following expansion in proliferation medium, MTEC showed a limited proliferation capacity, with the presence of swollen cells with enlarged vacuoles (Fig. 1b). We were unable to successfully passage MTEC grown in proliferation medium. Because we considered the possibility that proliferation medium may be defcient in factors preventing senescence, we switched to another medium. Keratinocyte Serum Free medium supplemented with epithelial growth factor (EGF), Bovine pituitary extract (BPE) and isoproterenol (KSFM) allows for expansion of human airway epithelial cells in vitro15,16. Additionally, adding a selective inhibitor of Rho-associated, coiled-coil containing protein kinase (ROCK), Y-27632, to the culture medium has been shown to increase proliferation of airway epithelial cells17. Growing MTEC in KSFM with Y-27632 indeed resulted in improved cellular expansion, survival and morphology (Fig. 1b). However, despite improved cell morphology and survival, the expansion rate was very slow and still a large number of enlarged cells were present. Notch signaling has been shown to play a pivotal role in preserving the basal cell population and in subsequent diferentiation into specialized cell types. Furthermore, inhibition of Notch signaling has been shown to lead to an increased number of basal cells in mouse ALI cultures10–12,18,19. To evaluate whether inhibition of Notch signaling promotes the expansion of MTEC afer isolation, we added DAPT, a γ-secretase inhibitor and indirect Notch signaling inhibitor, to the KSFM medium containing Y-27632. Growing MTEC in the presence of DAPT and Y-27632 in KSFM medium resulted in a marked increase in proliferation rate with a slightly better morphology compared to cells grown in absence of DAPT; these diferences were already apparent afer 5 days of culture of P0 cells, but even more afer passaging whereby an increased number of transwell inserts could be obtained when DAPT was present during expansion (Fig. 1c). KSFM medium containing Y-27632 and DAPT will be further referred to as KSFM expansion medium. Notably, expanding MTEC from two mice in KSFM expansion medium resulted in 42.5 million cells, sufcient for 85 transwell inserts when plated at a density of 8×104 cells/cm2 , which is in stark contrast to the 200,000 cells required for 4–5 transwell inserts that are obtained if MTEC were isolated and cultured directly onto the transwell inserts. Also, no contaminating fbroblasts were observed during MTEC expansion. Taken together, we conclude that MTEC expansion is more efcient in the presence of the Notch signaling inhibitor DAPT than without
این متن به صورت کامل توسط google translate ترجمه شده است.
نتایج
رسانه بدون سرم و مهار نشانه گیری Notch باعث گسترش سلول های پایه می شود.
اگر چه روش های فعلی کشت ALI نشان دهنده اپیتلیوم فشرده شده فشرده شده در محیط آزمایشگاهی است، محدودیت از این تکنیک، تعداد نسبتا کم سلول های حاصل از یک تراشه است. ما بر اساس اعتبار موجودروش کشت MTEC که در آن MTEC جداگانه به طور مستقیم بر روی درجهای transwell کشت می شود (شکل S1). تیس روش کشت اجازه می دهد ما را به تقریبا 4 تا 5 درج transwell (50000 سلول در هر قرار) با استفاده از دو موش (± 100،000 سلول در هر تراشه). بهبود گسترش MTEC اجازه خواهد داد تا چندین آزمایش انجام شود با موش کمتر. در حالت ایده آل، پس از جداسازی از تراشه، سلول ها می توانند در حداقل برای کشت گسترش پیدا کنند دو پاساژ برای تولید سلول های با نفوذ برای آزمایش های متعدد (شکل 1a). در مطالعات قبلی MTEC جدا شده است و در محيط تکثير قرار داده شده و پس از رسيدن به محفظه، در ALI کشت شده است
متوسط (جدول S1) 13،14. پس از گسترش در محدوده تکثیر، MTEC نشان داد که تکثیر محدودی دارد ظرفیت، با حضور سلول های متورم با واکسن های بزرگ (شکل 1b). ما نتوانستیم به موفقیت برسیم MTEC در محیط پرورش افزایش یافته است. از آنجا که ما این امکان را در نظر گرفتیم که محرک انتشار می تواند باشد در عواملی که مانع از پیری می شود، ما به یک محیط دیگر تبدیل شده ایم. Keratinocyte سرم آزاد محیط ضمیمه با فاکتور رشد اپیتلیال (EGF)، عصاره هیپوفیز گاو (BPE) و ایزوپروترنول (KSFM) اجازه می دهد تا برای گسترش سلول های اپیتلیال فضایی انسانی در vitro15،16. علاوه بر این، اضافه کردن یک مهار کننده انتخابی از Rho-linked coil-coil حاوی پروتئین کیناز (ROCK)، Y-27632، به محیط کشت نشان داده شده است برای افزایش تکثیر سلول های اپیتلیال هواپیما 17. در حال رشد MTEC در KSFM با Y-27632 در واقع باعث شد بهبود سلول، بقا و مورفولوژی (شکل 1b). با این حال، علیرغم بهبود مورفولوژی سلولی و بقای، سرعت رشد بسیار کند بود و همچنان تعداد زیادی از سلولهای بزرگ وجود داشت. نشانه گیری نشان داده شده است نقش مهمی در حفظ جمعیت سلول پایه و در تفاوت های بعدی دارد
به انواع سلول های تخصصی. علاوه بر این، مهار نشانه گیری Notch منجر به افزایش است
تعداد سلول های بازال در کشت های موس ALI 10-12،18،19. برای ارزیابی اینکه آیا مهار نشانه گیری Notch ترویج می شود گسترش جداسازی MTEC، ما DAPT، یک مهار کننده ی γ-secretase و سیگنالینگ Notch غیر مستقیم مهار کننده، به محیط KSFM حاوی Y-27632. افزایش MTEC در حضور DAPT و Y-27632 در محيط KSFM موجب افزايش قابل ملاحظه اي در ميزان تکثير با مورفولوژي نسبتا بهتر شد
به سلول هایی که در غیاب DAPT رشد می کنند؛ این تفاوت ها قبلا آشکار شده بود 5 روز کشت سلول های P0، اما حتی بیشتر passers permission که به موجب آن تعداد بیشتری از inserts transwell می تواند در هنگام DAPT به دست آمده است در حال حاضر در طول گسترش (شکل 1c). محتوی KSFM حاوی Y-27632 و DAPT بیشتر به عنوان رسانه توسعه KSFM.به طور قابل توجهی، گسترش MTEC از دو موش در محیط توسعه KSFM به 42.5 میلیون سلول، با شکوه تبدیل شد برای 85 تاج و تخت در حالی که با تراکم 8 × 104 قرار داده شده است سلول / cm2، که در مقایسه با 200،000 است سلول های مورد نیاز برای 4-5 ترانس وول درج است که به دست می آید اگر MTEC جدا شده و کشت شده به طور مستقیم بر روی transwell inserts. همچنین، در طول توسعه MTEC، هیچ فبریبلاست آلوده نشد. گرفته شده با هم، ما نتیجه می گیریم که گسترش MTEC در مقایسه با DOTT مهارکننده سیگنال Notch بیشتر است بدون
برای دانلود این مقاله کلیک کنید.