کریسپر و فناوری تولید سلولهای بنیادی پرتوان القایی (معروف به سلولهای iPS)، دو حوزه جذاب زیست شناسی مدرن هستند و مقاله ای که به تازگی در زمینه تولید سلولهای iPS چاپ شده است، این دو فناوری را به زیبایی با هم تلفیق می کند.
از سال 2006 و 2007 که برای نخستین بار تولید سلولهای iPS موشی و انسانی گزارش شد، روشهای مختلف و متعددی برای تولید سلولهای iPS ارزیابی و ارائه شده اند. در طول زمان، ما اطلاعات بسیار هنگفتی کسب کردیم درباره اینکه پرتوانی چگونه در مرحله «حفظ و نگهداری» و همچنین در مرحله «تولید و القا» تنظیم می شود؟
همین چندسال پیش بود که رویکردهای کاملا کوچک مولکولی به تولید سلولهای iPS ارائه شدند. در نخستین سالها، اینگونه به نظر می رسید که تقریبا هر روش جدیدی که برای تولید سلولهای iPS پیشنهاد می شود، می توانست در مجلات با ضریب نفوذ و اعتبار بالا چاپ شود. سرانجام، پیشرفت های روش شناختی در این زمینه به صورت عادی درآمدند. اکنون این مطالعه جدید که در آزمایشگاه دکتر شنگ دینگ در آمریکا انجام شده است، حرکت جدیدی را در عرصه بازبرنامه ریزی پرتوانی به نمایش می گذارد.
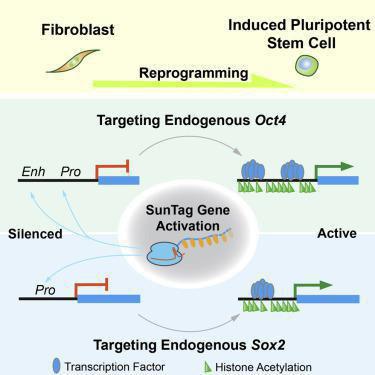
لب مطلب در این مطالعه، آن است که سیستم های اپی ژنتیکیِ کریسپری (نه انواع ژنتیکی و ویرایشی ژنوم آن) را می توان برای روشن کردن دو ژن مهم پرتوانی یعنی Oct4 و Sox2 در سلولهای موشی بکار برد و سلولهای iPS را ایجاد کرد. سیستم های اپی ژنتیکی کریسپر، قبلا برای روشن یا خاموش کردن ژنها به واسطه چسباندنِ دومین های تنظیمی (مشتق از برخی پروتئین های تنظیم کننده ساختار کروماتین) به آنزیم dCas9 استفاده شده اند. در حقیقت فعال سازی ژن به وسیله کریسپر (موسوم به CRISPRa) قبلا برای روشن کردن ژنهای پرتوانی به کار رفته است، اما تاکنون هیچ گزارش مبنی بر تولید سلولهای iPS با این رویکرد ارائه نشده بود.
در این مطالعه، جالب اینجاست که فعال کردن Sox2 به کمک CRISPRa مطابق گزارش، برای تولید سلولهای iPS کافی بوده است، این در حالی است که Sox2 یک ژنِ «صرفا پرتوانی» نیست و قبلا به تنهایی برای تولید سلولهای iPS به کار نرفته است. نویسندگان این مقاله ذکر می کنند که فقط 0.1% از سلولهای اولیه توانستند با فعال سازی Sox2 درون زاد، به سلولهای iPS تبدیل شوند، این در حالی است که در حدود 20% از سلولها، سیستم CRISPRa توانسته بود Sox2 را روشن کند. این مشاهده حاکی از آن است که احتمالا وقایع مولکولی دیگری باید رقم بخورند یا همان طور که خود نویسندگان می گویند “صرف فعال شدن Sox2 برای تغییر کارآمد سرنوشت سلولها کافی نیست”. چنانچه این رویکرد تکرارپذیر باشد، قاعدتا در سلولهای غیرپرتوانی که Sox2 را بیان می کنند، باید مکانیسم هایی برای مهار تغییریافتن سلولها به حالت پرتوان وجود داشته باشند (مثلا جلوگیری از روشن شدن Oct4).
همچنین روشن کردن Oct4 توسط CRISPRa نیز توانست به تنهایی به تولید سلولهای iPS منجر شود که در نوع خود جالب است، چرا که بازبرنامه ریزی توسط Oct4 به تنهایی در بسترهای مشابه گزارش نشده است. مشاهده دیگر نویسندگان آن بود که فعال کردن اپی ژنتیکی و همزمان راه انداز (promoter) و افزاینده (enhancer) ژن Oct4، نتیجه بهتری به دست می دهد. در واقع فعال سازی راه انداز، به روشن شدن سریع و قوی، و فعال سازی افزاینده به روشن شدن کندتر و ضعیف تر اما پیوسته ی ژن Oct4 منجر می شود.
تمرکز این مطالعه بر سلولهای موشی بود و بنابراین انتظار می رود که بزودی گزارش مشابهی برای سلولهای انسانی ارائه شود. یک محدودیت این مطالعه، بکارنبردن یک رویکرد بی طرف در پیداکردن هدفگیری های غیراختصاصی سیستم CRISPRa است که بجای این کار، صرفا به برخی از جایگاه های هدفگیری غیراختصاصی که قبلا گزارش شده بودند، می پردازد.
این نوع رویکرد برای تغییر سرنوشت سلولها را می توان به فرآیند دگرتمایزی (تبدیل سلولهای تمایزیافته به یکدیگر) هم تعمیم داد و بررسی کرد که آیا می توان سلولهای مهمی نظیر سلولهای بنیادی عصبی را با این منطق که نیازمند دستکاری ژنتیکی نیست، تولید کرد؟ یک علت برای این نکته که چرا مطالعات قبلی نتوانستند با همین سیستم سلولهای iPS را ایجاد کنند، می تواند این باشد که در مطالعه اخیر، افزایش بیان شاخص تری در مقایسه با مطالعات قبلی گزارش می شود؛ همچنین بکاربردن کوچک مولکولهای محرک پرتوانی در مطالعه اخیر نیز می تواند دلیلی برای موفقیت آزمایشگاه دکتر دینگ نسبت به سایرین باشد.
ترجمه (با دخل و تصرف اندک): دکتر شریف مرادی، پژوهشگر سلولهای بنیادی و سرطان، پژوهشگاه رویان
برای دسترسی به مقاله اصلی کلیک کنید.